| |
| Med Sci (Paris). 2003 October; 19(10): 1011–1015. Published online 2003 October 15. doi: 10.1051/medsci/200319101011.Santé publique : le contrôle des maladies méningococciques au Québec Philippe De Wals,1* Bernard Duval,2 Gaston De Serres,1 Nicole Boulianne,2 and Marc Dionne2 1Département de médecine sociale et préventive, Université Laval, Pavillon de l’Est, 2180, chemin Sainte-Foy, local 1110, Québec, G1K 7P4 Canada 2Institut national de santé publique du Québec et Unité de recherche en santé publique, Centre hospitalier universitaire de Québec, Canada |
La médecine fondée sur les preuves signifie l’intégration de l’expertise clinique des praticiens aux meilleures données scientifiques résultant d’une recherche systématique de qualité [
1]. Ces principes s’appliquent à la santé publique, domaine dans lequel les décisions concernant l’implantation de programmes doivent reposer sur l’ensemble des données objectives touchant à l’efficacité et à la sécurité des interventions, leur pertinence, leur efficience, leur acceptabilité et leur faisabilité, mais aussi sur le jugement d’experts pour ce qui est des zones d’incertitudes. L’histoire des maladies méningococciques de sérogroupeC au Québec durant la dernière décennie illustre le cheminement des scientifiques et des responsables de santé publique dans la voie d’une plus grande rigueur dans le processus de prise de décision d’une stratégie de contrôle, la sélection d’un vaccin et les modalités de son utilisation. La thèse défendue par les auteurs est que l’implantation de tout nouveau programme doit intégrer une composante évaluative et s’accompagner, si possible, d’un volet de recherche et de développement technologique. Dans certaines conditions, les dividendes d’un tel investissement peuvent être rapides et considérables. |
Première recrudescence causée par le sérogroupe C, 1990-1993 Depuis la seconde guerre mondiale, les infections invasives à méningocoques étaient endémiques au Canada, avec une incidence annuelle de l’ordre de 1cas pour 100000 et une prédominance du sérogroupeB, affectant principalement les jeunes enfants [
2]. En 1986, on observe l’émergence d’un clone virulent de sérogroupe C et de sérotype 2a [
3]. Ce clone se répand en Ontario, tout d’abord, et au Québec par la suite. Les données de surveillance épidémiologique sont encore très fragmentaires à l’époque, mais une augmentation globale d’incidence est notée dès l’hiver 1990, avec des agrégats spatiotemporels, une mortalité élevée et un risque de maladie accru chez les adolescents [
4]. Un vaccin polysaccharidique actif contre le méningocoque de sérogroupe C avait été développé durant les années 1960 et son efficacité avait été testée auprès des recrues de l’armée américaine [
5]. Il n’existait cependant qu’une seule étude expérimentale chez des jeunes enfants au Brésil, indiquant une protection de faible niveau [
6]. Une première vaccination est faite pour contrôler une éclosion à Beauceville, en février 1991, impliquant 1100enfants âgés de 2 à 11 ans, et une seconde intervention vise 1500clients d’un bar à Boucherville [
7]. À la fin de l’année 1991, une réunion d’experts est organisée à Montréal et le groupe se prononce pour l’utilisation du vaccin de façon plus large, mais ciblée en fonction de critères décisionnels empiriques. L’année suivante, les interventions se multiplient et près de 300 000 personnes sont immunisées dans différentes régions. Les personnes vaccinées semblent protégées, mais l’épidémie n’est pas contrôlée pour autant, une centaine de cas étant recensés durant l’année. Vu l’échec relatif de la stratégie de vaccination en foyer et une croissance de la pression populaire et médiatique, les autorités de santé publique demandent au groupe d’experts de faire une estimation du coût et de l’impact potentiel d’une campagne d’immunisation de masse. Malgré l’incertitude qui existe sur l’efficacité à long terme du vaccin et sa capacité à protéger les plus jeunes, la décision est prise d’offrir l’immunisation à tous les Québécois âgés de 6 mois à 20ans. Le stock de vaccins disponible au Canada étant insuffisant, des procédures rapides d’homologation sont adoptées pour permettre l’importation de produits européens. La campagne d’immunisation de masse est réalisée durant l’hiver 1993. La grande majorité des vaccins sont administrés par le réseau public de services de santé de première ligne, les CLSC (centre local de services communautaires) répartis sur tout le territoire québécois. Au total, 1 625 000 doses de vaccins sont administrées, pour une couverture de la population cible de 84% [
8]. |
Évaluation de la campagne d’immunisation Le caractère exceptionnel de la campagne d’immunisation de masse contre le méningocoque de sérogroupeC au Québec incite les autorités de santé publique à entreprendre une évaluation rigoureuse[7]. La première mesure consiste à mettre en place un registre provincial d’immunisation à partir des fiches individuelles transmises par les vaccinateurs. Il apparaît toutefois que le registre n’est pas complet et qu’il faut introduire des corrections à partir des statistiques de distribution des vaccins pour produire des estimations précises des taux de couverture vaccinale [8]. Une deuxième mesure vise à renforcer le système de surveillance épidémiologique fondé sur la déclaration par les médecins et les laboratoires. Des procédures de validation des informations sont instaurées. Tous les laboratoires sont invités à transmettre les isolats de Neisseria meningitidis au Laboratoire de Santé publique du Québec. Une étude réalisée dans la région de Montréal fait état d’une excellente concordance (88%) entre les cas d’infections méningococciques enregistrés par le système de surveillance des maladies à déclaration obligatoire et ceux enregistrés dans le fichier provincial des résumés d’hospitalisation [
9]. Une troisième mesure est d’améliorer le système de rapport des manifestations cliniques survenues après la vaccination, en incitant les vaccinateurs à signaler toute réaction anormale et en validant et standardisant les informations récoltées au niveau provincial. Une analyse de tous les incidents rapportés durant la campagne de masse a permis de confirmer le caractère hautement inoffensif des vaccins méningococciques polysaccharidiques, d’estimer à 1 par million la fréquence des réactions anaphylactiques et de démontrer l’efficacité des mesures mises en place pour prévenir les complications liées à ce type de réaction [
10]. Par ailleurs, un comité composé de chercheurs et de responsables de santé publique est invité à définir un programme de recherche évaluative et un financement spécial de 400000dollars y est affecté. Une première recherche ayant pour objectif de documenter l’histoire naturelle de la maladie met en évidence la fréquence élevée de formes septicémiques lors d’infection par des souches de sérogroupe C, un taux de mortalité de 14% (comparé à 7% pour le sérogroupe B) et l’existence dans 15% des cas de séquelles chez les survivants, principalement associées à des nécroses tissulaires (comparé à 3% de séquelles pour le sérogroupe B) [
11]. Une étude d’immunogénicité du vaccin confirme la faible réponse sérique en anticorps bactéricides chez les enfants de moins de 2 ans [
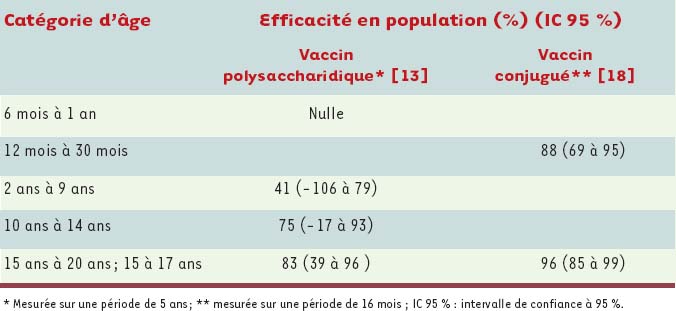
12]. Partant des données du fichier de surveillance des maladies à déclaration obligatoire et du registre de vaccination, une analyse de type cohorte détermine, pour la première fois, des taux de protection en fonction de l’âge, sur une période de 5 ans (Tableau I) [
13]. L’analyse de l’évolution des taux d’incidence dans différents groupes d’âges indique une réduction de la transmission de la bactérie dans le groupe d’âge ciblé par la campagne, mais non vacciné [8]. Finalement, une analyse économique établit le coût de la campagne à environ 26millions de dollars, alors qu’un total de 74 cas ont été prévenus durant les cinq années suivantes [
14].
 | Tableau I.
Efficacité comparée des vaccins polysaccharidique et conjugué contre le méningocoque de sérogroupe C.
|
|
Développement du vaccin conjugué Durant les années 1990, une augmentation de l’incidence des maladies méningococciques de sérogroupe C est constatée dans plusieurs pays d’Europe, dont le Royaume-Uni [
15]. Les nouvelles connaissances en immunologie permettent de mieux comprendre les limites des vaccins antibactériens polysaccharidiques, qui induisent une réponse immunitaire thymo-indépendante, immature chez l’enfant et sans mémoire ; elles permettent aussi d’apprécier les avantages potentiels d’une conjugaison du polysaccharide à une protéine, ce qui modifie la nature de la réponse qui devient thymodépendante, effective dès la naissance et inductrice d’une mémoire [
16]. En concertation avec les pouvoirs publics britanniques, plusieurs compagnies développent des vaccins conjugués contre le méningocoque de sérogroupe C, qui sont homologués sur la base de leur profil immunogénique, mais sans qu’aucun essai clinique démontre leur efficacité [
17]. En 1999, une campagne d’immunisation de masse est lancée au Royaume-Uni, visant les 15 millions de personnes âgées de moins de 18ans [
18]. L’estimation de l’efficacité à court terme du vaccin conjugué démontre sa supériorité sur le vaccin polysaccharidique (Tableau I). Durant toute cette période, des contacts réguliers sont maintenus entre les responsables de santé publique et les chercheurs britanniques et canadiens, permettant l’échange de données non publiées et des discussions sur les avantages et inconvénients de différentes stratégies de contrôle. |
Deuxième recrudescence causée par le sérogroupe C, 2001-2002 Après la campagne d’immunisation de masse achevée en mars 1993, l’incidence des maladies méningococciques de sérogroupe C est restée faible au Québec, avec une incidence annuelle de l’ordre de 1 par million. Brusquement, une nouvelle recrudescence débute en février 2001, principalement dans la ville de Québec et sa région. Elle est causée par un clone apparenté à celui responsable de l’épidémie de 1990-1993, et la virulence comme les caractéristiques épidémiologiques sont semblables. Toute l’histoire est encore fraîche dans la mémoire populaire et la pression médiatique devient rapidement intense. La décision est prise de débuter immédiatement la vaccination du groupe d’âge 12-20ans dans les régions les plus touchées avec le vaccin polysaccharidique et de procéder, avec l’aide de Santé Canada, à l’homologation du vaccin conjugué en suivant une procédure rapide, ce qui est fait en mai 2001. Les premières doses disponibles servent à vacciner les enfants âgés de 2 mois à 11 ans dans la région de Québec. Un groupe d’experts est convié à faire des prédictions sur l’évolution de la situation, en suivant une procédure de type Delphi de recherche de consensus [
19], et le scénario considéré comme le plus probable est une répétition de l’épidémie de 1990-1993. Un modèle décisionnel est rapidement élaboré, afin d’évaluer le coût et les avantages de stratégies de contrôle alternatives utilisant le vaccin polysaccharidique, le conjugué, ou une combinaison des deux [
20]. Les paramètres du modèle sont basés sur les résultats des études évaluatives réalisées au Québec et au Royaume-Uni. Les simulations indiquent que la stratégie la plus dispendieuse mais la plus efficace est celle qui utilise le seul vaccin conjugué. Les autorités de santé publique considèrent qu’il serait inacceptable de priver la population du meilleur vaccin. Durant l’été, une campagne d’immunisation de masse est planifiée à l’échelon provincial et réalisée durant l’automne, avant que débute la recrudescence hivernale traditionnelle. Cette campagne touche 83% des 1,9million de personnes âgées de 2 mois à 20ans, pour un coût de plus de 100 millions de dollars. Aucun incident majeur n’est rapporté, et un seul échec est signalé à ce jour avec le vaccin conjugué (juin 2003). L’épidémie semble contrôlée. Une enquête d’opinion, réalisée durant l’hiver 2002, a montré un fort soutien vis-à-vis de la campagne d’immunisation et la majorité des personnes interrogées considéraient l’investissement financier comme tout à fait acceptable [
21]. La question qui s’est alors posée était celle d’inclure ou non le vaccin méningococcique conjugué dans le calendrier régulier d’immunisation. Un modèle d’analyse épidémiologique et économique a été élaboré, afin de comparer l’impact de différentes stratégies d’immunisation en fonction de différents scénarios épidémiologiques sur une période de cinquante ans [
22]. Dans l’hypothèse, considérée comme très probable par les experts, d’un faible déclin de l’immunité vaccinale au fil des ans, la stratégie la plus efficace consiste à administrer trois doses de vaccin conjugué en bas âge, mais cela est très coûteux, avec un produit vendu 50 dollars l’unité. La stratégie de contrôle la plus efficiente consiste à administrer une seule dose de vaccin conjugué à l’âge de 12mois, en même temps que la vaccination rougeolerubéole- oreillons. Pour les scénarios épidémiologiques les plus probables (une à quatre épidémies en 50 ans) et en actualisant les coûts et bénéfices au taux de 3% par an, les indices coût-efficacité exprimés en coût incrémental par année de vie sauvée sont alors compris entre 9000dollars et 35000dollars, ce qui est considéré comme tout à fait acceptable [
23]. Sur cette base, la décision a été prise d’introduire un programme d’immunisation de routine avec une seule dose à l’âge de 12mois. Ce programme, qui a débuté en décembre 2002, s’accompagne d’une évaluation prospective de son efficacité et, s’il s’avérait que l’immunité vaccinale diminue au fil des ans, il faudrait envisager de donner une dose de rappel, vers 12 ans par exemple. |
Les premières décisions concernant le contrôle d’une situation épidémique en 1990-1993 ont été prises dans un contexte de manque de connaissances sur l’efficacité du vaccin polysaccharidique, d’expertise limitée et en suivant un processus décisionnel peu rigoureux. La décision d’investir des ressources appréciables dans l’évaluation de la campagne d’immunisation et d’élaborer un programme de recherche opérationnelle fut avisée, car cela a permis de faire progresser les connaissances et de bâtir une expertise qui se sont révélées des plus utiles dix ans plus tard, lorsque survint la seconde éclosion. À ce moment, un nouveau vaccin conjugué était disponible et les décisions ont été prises de manière beaucoup plus systématique, en appliquant un cadre théorique qui considérait l’ensemble des dimensions scientifiques, sociales, économiques et politiques d’une problématique de santé et de stratégies de contrôle alternatives [
24]. Ces principes devraient s’appliquer à l’ensemble des programmes de santé publique. |
1. Sakett DL, Richardson WS, Rosenberg W, Haynes RB. Evidence-based medicine. How to practice and teach EBM. New York : Churchill Livingstone, 1997 : 250 p. 2. Varughese PV, Carter AO. Meningococcal disease in Canada. Surveillance summary to 1987. Can Dis Wkly Rep 1989; 15 : 89–96. 3. Ashton FE, Ryan JA, Borczyk A, Caugant DA, Mancino L, Huang D. Emergence of a virulent clone of Neisseria meningitidis serotype 2a that is associated with meningococcal group C disease in Canada. J Clin Microbiol 1991; 29 : 2489–93. 4. Lavigne P, Boulianne N, Fortin C, Naccache H, Douville-Fradet M. Meningococcal infections in Quebec, 1991-1992. Can Commun Dis Rep 1992; 18 : 113–6. 5. Frasch CE. Meningococcal vaccines : Past, present and future. In : Cartwright K, ed. Meningococcal disease. Chichester : John Wiley and Sons, 1995 : 245–83. 6. Taunay AE, Feldman RA, Bastos CO, Galvao PAA, Morais JS, Castro IO. Avaliação do efeito protector de vacina polissacaridica antimenigococica da grupo C, em crianças de 6 a 36 meses. Rev Inst Adolfo Lutz 1978; 32 : 77–82. 7. Direction de la protection de la santé publique. Bilan de la campagne de vaccination contre les infections à méningocoques. Décembre 1991 à avril 1993. Version initiale. Québec: Ministère de la Santé et des Services sociaux, 1994 : 176 p. 8. De Wals P, Dionne M, Douville-Fradet M, Boulianne N, Drapeau J, De Serres G. Impact of a mass immunization campaign against serogroup C meningococcus in the province of Quebec, Canada. Bull WHO 1996; 74 : 407–11. 9. Rivest P, Sagot B, Bédard L. Evaluation of the completeness of reporting of invasive meningococcal disease. Can J Publ Health 1999; 90 : 250–2. 10. Yergeau A, Alain L, Pless R et al. Adverse events temporally associated with meningococcal vaccines. Can Med Assoc J 1996; 154 : 503–7. 11. Erickson L, De Wals P. Complications and sequelae of meningococcal disease in Quebec (Canada) 1990-1994. Clin Infect Dis 1998; 26 : 1159–64. 12. Lebel MH, Tapiero BF, Saintonge F. Immunogenicity of bivalent AC polysaccharide meningococcal vaccine in children aged 6 through 24 months. JAMA 2001; 285 : 1578–9. 13. De Wals P, De Serres G, Niyonsenga T. Effectiveness of a mass immunization campaign against serogroup C meningococcal disease in Quebec. JAMA 2001; 285 : 177–81. 14. De Wals P, Erickson L. Economic analysis of the 1992-1993 mass immunization campaign against serogroup C meningococcal disease in Quebec. Vaccine 2002; 20 : 2840–4. 16. Stein KE. Thymus-independent and thymus-dependent responses to polysaccharide antigens. J Infect Dis 1992; 165 (suppl 1) : S49–52. 17. Pollard AJ, Maiden MCJ. Meningococcal vaccines. Methods and protocols. Totowa, New Jersey : Humana Press, 2001 : 422 p. 18. Miller E, Salisbury D, Ramsay M. Planning, registration, and implementation of an immunisation campaign against meningococcal serogroup C disease in the UK : a success story. Vaccine 2002; 20 : S58–67. 19. Delbecq AL, Van de Ven AH, Gustafson DH. Group techniques for program planning : A guide to nominal group and Delphi processes. Glenview, Illinois : Scott, Foresman and Company, 1975. 20. Comité sur l’immunisation du Québec. Évaluation du coût et des avantages potentiels d’une campagne d’immunisation contre le méningocoque de sérogroupe C au Québec. Québec: Institut de santé publique du Québec, 2001 : 1–20. ( http://www.inspq.qc.ca). 21. De Wals P, Allard MA, Guindon K, Mayrand L, Simard S, Black R. La vaccination contre le méningocoque est-elle utile ? Résultats d’une enquête dans la région de Sherbrooke. Can Commun Dis Rep 2002; 28 : 61–3. 22. Comité sur l’immunisation du Québec. Pertinence de l’introduction du vaccin méningococcique dans le calendrier régulier d’immunisation au Québec. Québec: Institut de santé publique du Québec, 2002 : 1–16. ( http://www.inspq.qc.ca). 23. Laupacis A, Feeny D, Detsky AS, Tugwell PX. How attractive does a new technology have to warrant adoption and utilization ? Tentative guidelines for using clinical and economic evaluations. Can Med Assoc J 1992; 146 : 473–81. 24. Erickson LJ, De Wals P, Farand L. Equitable access to vaccination : Immunization program planning in Canada. Report presented to the Division of Immunization, Health Canada, Ottawa, May 22, 2001. |